LipiDye®-M <Lipid Metabolism Tracer>
用于脂肪酸代谢过程的多色活细胞成像试剂
LipiDye®-M是一种由环境响应荧光染料标记的荧光标记脂肪酸。LipiDye®-M的荧光颜色会根据脂质的代谢状态及其周围环境的不同发生明显的变化,因此可以通过绿色、黄色和红色荧光反应观察到脂肪酸的代谢过程。本产品可用于脂质代谢相关的基础研究和以脂质代谢为靶点的药物开发研究。
※本产品是以名古屋大学transformative生物分子研究所 山口茂弘教授和多喜正泰特任副教授 的研究成果为基础,由Funakoshi株式会社进行商品化并销售。
※本产品仅供研究,研究以外不可使用。

LipiDye®-M细胞内脂质代谢过程图(左)和染色示例(右)
LipiDye®-M是一种环境响应性染料标记脂肪酸,它的特性是通过脂肪酸转运蛋白进入细胞后,在细胞内参与脂质代谢过程时,荧光会随着每次局部反应变化而发生变化。通过成像获取绿色荧光和红色荧光图像并将两者叠加,可以观察到与脂质代谢状态相关的三种不同颜色的结果。
◆脂肪酸代謝与LipiDye®-M
脂肪酸是脂质的最小单位,在细胞内可转化为各种脂质结构,如酰基辅酶 A、磷脂、糖脂、甘油二酯(DAG)和甘油三酯(TAG)等。脂肪酸代谢受到多种酶的严格调控,因此酶和调控机制的改变也被认为与脂质代谢类疾病有关。为充分探究脂质的代谢过程,荧光标记脂肪酸作为分析脂肪酸代谢过程的工具被广泛使用,但由于其颜色不随脂肪酸代谢的过程而改变,因此难以区分各个代谢阶段并逐一进行分析。
LipiDye®-M(论文原名:AP-C12)是一种能够克服上述问题的新型荧光标记脂肪酸。由名古屋大学transformative生物分子研究所 山口茂弘教授和多喜正泰特任副教授研究开发,使用C12脂肪酸为载体,连接新型荧光色素Azapyrene,含荧光基团在内总长相当于C18脂肪酸(图1左)。Azapyrene不同于常规使用的荧光染料,能够识别周围分子的极性使吸收波长与荧光波长同时发生变化。Azapyrene具有在强极性环境(亲水性)中转变为绿色,在弱极性环境(疏水性)中转变为红色的特性。因此通过选择适宜的激发光源和检测波段,可以区分和观察各种环境中的脂质代谢状态。
|
|
图 1:LipiDye®-M结构与环境响应 | |
根据上述性质,LipiDye®-M通过脂肪酸转运蛋白摄入细胞后,在细胞内参与脂质代谢过程,转化为各种脂质结构。在其转移到细胞内的不同位置后,即如图2所示,荧光颜色会根据细胞器膜极性发生变化。通过荧光显微镜观察使用LipiDye®-M处理后的活细胞,得到绿色荧光图(激发:450-490 nm,推荐:473 nm;发射:490-540 nm)和红色荧光图(激发:540-600 nm,推荐:559 nm;发射:570-620 nm),将两者重叠后即可获得如图3所示的三色可视化脂质代谢状态图。在重叠后的图像中,细胞质(游离脂肪酸,酰化CoA)及线粒体腔(β脂肪酸氧化代谢产物)显示为绿色,各种细胞器膜(磷脂,DAG等)显示为黄色,脂滴(TAG)显示为红色。对绿色荧光图与红色荧光图进行各种比率分析,可进行进一步的定量解析。若想了解根据比率解析进行定量解析的方法,请参考原著论文[1]。

图2:LipiDye®-M代谢过程与荧光变化过程图
|
|
|
细胞质 线粒体腔 细胞器膜 脂滴 | 细胞质 线粒体腔 细胞器膜 脂滴 | 细胞质 线粒体腔 细胞器膜 脂滴 |
图 3:LipiDye®-M活细胞三色图像示意图 | ||
◆特点
● 根据脂肪酸代谢和细胞器环境的不同,荧光颜色呈绿色~红色变化。
● 可根据荧光图追踪脂肪酸代谢过程。
● 作为游离脂肪酸的LipiDye®-M通过脂肪酸转运蛋白进入细胞后,在细胞内可转化为酰基辅酶 A、甘油二酯(DAG)、甘油三酯(TAG)、磷脂及
β脂肪酸氧化产物。
● 荧光在强极性环境(细胞质)下呈绿色、中极性环境(细胞膜)下呈黄色、弱极性环境(脂滴)下呈红色。
● 绿色荧光图(激发:450-490 nm,推荐:473 nm;发射:490-540 nm)和红色荧光图(激发:540-600 nm,推荐:559 nm;发射:570-
620 nm),将两者重叠后可获得三色可视化脂质代谢状态图。通过所得的绿色/红色荧光比率,可进行定量比率分析。
荧光波长(激发/发射波长)
为了准确观察LipiDye®-M的环境响应性差异,需要确定最佳激发波长和荧光波长。推荐使用共聚焦激光扫描显微镜进行观察,实验时可参考下表范围。
激发波长范围 | 发射波长范围 | |
绿色荧光 | 450~490 nm (推荐使用457, 473 nm激光扫描) ※ 488 nm激发后的荧光可能会偏弱 | 490~540 nm |
红色荧光 | 550~600 nm (推荐使用560 nm激光扫描) | 570~620 nm |
|
|
LipiDye®-M的激发光谱 | LipiDye®-M的发射光谱 |
LipiDye®-M在PBS、磷脂脂质体和大豆油中的激发光谱和发射光谱
◆应用实例
脂肪细胞染色例

向脂肪细胞(由3T3-L1细胞分化)中添加LipiDye®-M(5μM),添加后无需清洗,分别在1分钟后和30分钟后,使用共聚焦激光扫描显微镜观察荧光(Green channel Ex 473 nm / Em 490~540 nm,Red channel Ex 559 nm / Em 570~620 nm)。添加1分钟后,从细胞质中观察到较强的绿色荧光信号。同时观察到脂滴的红色荧光信号较弱,因此可推测LipiDye®-M主要以游离脂肪酸或脂肪酸CoA状态存在于细胞中,尚未被脂滴充分摄入。添加30分钟后,绿色荧光信号减弱,脂滴的红色荧光信号增强,LipiDye®-M转变为TAG,由此可推测脂滴已充分摄入LipiDye®-M。使用TAG合成酶(DGAT)抑制剂进行处理,30分钟后,能观察到脂滴的红色荧光信号明显被抑制,内质网(ER)等细胞器膜呈现的黄色荧光信号增强。这一结果表明,LipiDye®-M在转化为DAG后并未继续转化为TAG,而是滞留于内质网等细胞器膜上。
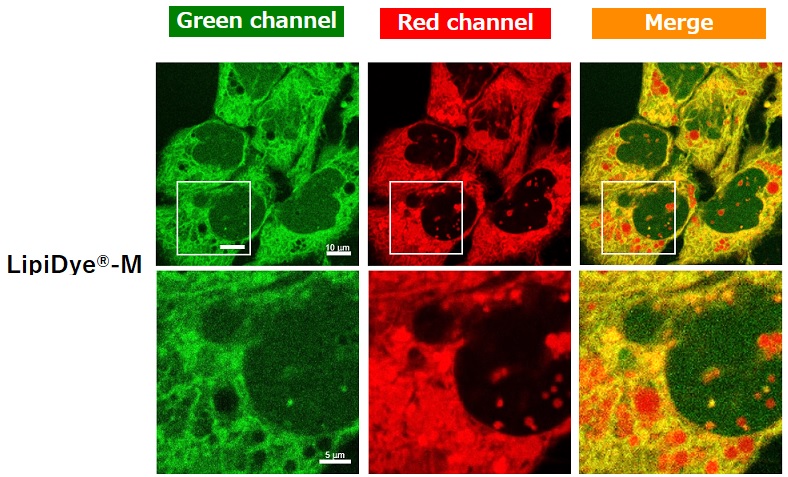
HepG2细胞染色例
|
|
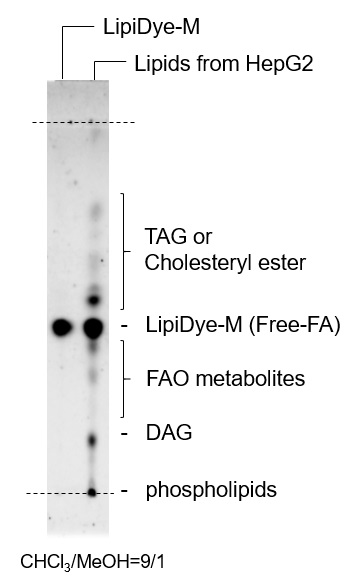
在含有油酸和棕榈酸的10% FBS条件下培养HepG2细胞,以促进脂滴产生。使用HBSS替换培养基,在饥饿状态下使用LipiDye®-M(5μM)处理60分钟后,于未洗涤条件下使用共聚焦激光扫描显微镜观察(Green channel Ex 473 nm / Em 490~540 nm,Red channel Ex 559 nm / Em 570~620 nm)。细胞饥饿状态下可观察到LipiDye®-M分布于HepG2细胞的细胞质(绿色),内质网(黄色),脂滴(红色)及线粒体(黄色)中。为确认LipiDye®-M的代谢状态,抽取HepG2细胞中的脂质成分并使用TLC分离后,以LipiDye®-M的荧光为指标进行检测。观察到TLC板上的多点表明,LipiDye®-M在HepG2细胞中被转化为各种脂质,TAG或胆固醇酯分布在游离脂肪酸型LipiDye®-M的上方(高疏水性),细胞器中的β脂肪酸氧化(FAO)代谢产物和DAG分布在下方(低疏水性),磷脂则被认为分布在原点附近。
为确认LipiDye®-M的代谢状态,抽取HepG2细胞中的脂质成分并使用TLC分离后,以LipiDye®-M的荧光为指标进行检测。观察到TLC板上的多点表明,LipiDye®-M在HepG2细胞中被转化为各种脂质,TAG或胆固醇酯分布在游离脂肪酸型LipiDye®-M的上方(高疏水性),细胞器中的β脂肪酸氧化(FAO)代谢产物和DAG分布在下方(低疏水性),磷脂则被认为分布在原点附近。
药物处理引起的脂质代谢变化

在含有CoA合成酶(ACS)抑制剂(Triacsin C)或TAG合成酶DGAT1抑制剂 (T863)的完全培养基中,对HepG2 细胞进行18小时的预处理,以抑制细胞内代谢途径(右图)。之后,为了促进脂滴的产生,在饥饿条件下用含有油酸 (0.5 mM)、抑制剂和 LipiDye®-M(5 μM)的HBSS培养基处理细胞6小时。在未洗涤的条件下使用共聚焦激光扫描显微镜(Green channel Ex 473 nm / Em 490~540 nm,Red channel Ex 559nm / Em 570~620 nm)进行观察。与对照组中脂滴的强红色荧光相比,经ACS抑制剂处理后的细胞中脂滴的红色荧光和细胞器膜的黄色荧光变弱,观察到绿色荧光较强。而另一组经DGAT1抑制剂处理后的细胞中,脂滴的红色荧光几乎无法用肉眼识别,细胞器膜的黄色荧光显著增强。经过ACS抑制剂处理过后的细胞由于无法将含LipiDye®-M的游离脂肪酸转化成酰基CoA,因此仍然以游离脂肪酸的形态存在于细胞中。另外也确认到了DAG由于DGAT1抑制剂的影响无法转化成TAG,使其无法转移至脂滴并积聚在内质网及其他细胞器膜上。如上述实例所示,在使用药物对细胞进行处理时,可通过对LipiDye®-M进行局部荧光分析,了解药物参与脂质代谢的哪一过程。
脂质分解途径抑制剂的作用

在含有自噬抑制剂(50 nM Bafilomycin A1;自噬体-溶酶体膜融合抑制剂)或脂肪分解抑制剂(100 μM DEUP)的HBSS培养基和LipiDye®-M(5 μM)的HBSS中培养HepG2细胞6小时后,使用共聚焦激光扫描显微镜(Green channel Ex 473 nm / Em 490~540 nm,Red channel Ex 559nm / Em 570~620 nm)进行观察,得到重叠后的荧光图像和比率分析图。在重叠后的对照组荧光图像中,囊泡样结构(自噬体)的膜呈黄色,因此可推断由自噬引起的脂质分解受到了抑制。另外,在使用脂肪分解抑制剂培养HepG2细胞的组中,观察到重叠荧光图像中整体的红色荧光增强,由此可见LipiDye®-M多积累于脂滴中和细胞器膜上。
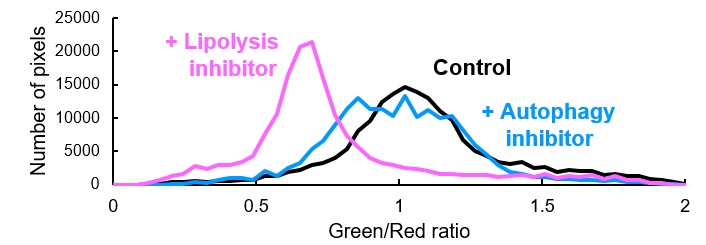
通过比率分析图和分布图可得知,相比于对照组和自噬抑制剂处理后的细胞,使用脂肪分解抑制剂处理的细胞其荧光Green/Red的比率大幅减少。
※具体的比率解析方法请参考原著论文。
◆参考资料:细胞毒性
| 用不同浓度的LipiDye®-M处理HepG2细胞,24小时后通过MTT测定评估细胞活力。此试剂的推荐浓度为5 μM,但在10 μM时仍未能观察到细胞毒性。从20 μM起确认到细胞毒性。 |
参考文献
[1] "A negative-solvatochromic fluorescent probe for visualizing intracellular distributions of fatty acid metabolites."
Kajiwara K., et al., Nat. Commun., 13 (1), 2533 (2022). [PMID:35534485]
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 备注 |
| FDV-0028 | LipiDye® -M <Lipid Metabolism Tracer> | 0.1 mg | - | - |
| 免责声明 |
|
1. 本公司密切关注本网站发布的内容,但不保证发布内容的准确性、完整性、可靠性和最新性等。 2. 本公司不保证使用本网站期间不会出现故障或计算机病毒污染的风险。 3. 无论何种原因,使用本网站时给用户或第三方造成的任何不利或损害,本公司概不负责。此外,对于用户与其他用户或第三方之间因本网站发生的任何交易、通讯 3. 或纠纷,本公司概不负责。 4. 本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。如任何用户将本网站提供的产品和服务用于临床诊断或治 4. 疗,以及其他特定的用途或行为,本公司概不保证其安全性和有效性,并且不负任何相关的法律责任。 |